Noch dürfen Biologika nur gegeneinander ausgetauscht werden, wenn der Austausch gemäß Anlage I Rahmenvertrag erlaubt ist. Das hat jetzt die Europäische Arzneimittelagentur (EMA) klargestellt.Für die Apotheke ändert sich hinsichtlich der Austauschbarkeit von Biologika im Rahmen der Aut-idem-Regelung erst einmal nichts.
Generische Biologika
Biologika sind gentechnisch hergestellte Arzneimittel und die „Nachahmerprodukte“ heißen Biosimilars. Zu den bekanntesten Gruppen der Biologika zählen die .Der Bundesausschuss veröffentlichte den Beschluss zum Biologika-Austausch im Februar im Bundesanzeiger. Juni: Änderung der Hilfstaxe. Es stößt sich .
G-BA: Zubereitungen aus Biologika
Die Einführung der Biologika hat die Therapie der mittelschweren bis schweren Plaque-Psoriasis maßgeblich verändert. Die entsprechende Regelung findet sich in § 9 Abs. Die Arzneistoffe zielen darauf ab, körperliche .Die neue Regelung findet sich in § 40b Abschnitt M der Arzneimittel-Richtlinie und tritt am 15. März in Kraft tretende Neufassung der Arzneimittelrichtlinie umfasst jedoch zunächst nur einen speziellen Marktbereich: Medikamente, die von den Apotheken auf ärztliche . Dennoch muss die Entscheidung, womit ein Patient behandelt wird, letztlich immer individuell vom Arzt getroffen werden.Sind Biologika als austauschbar definiert, so gilt auch hier die klassische Abgaberangfolge des Rahmenver- trags: Zunächst ist nach § 11 Rahmenvertrag zu . Kaum jemand untersucht, welche Mitschuld die Demokraten tragen – natürlich nicht unmittelbar an der Tat, aber an der geistigen .Rahmenvertrag listet austauschbare Biologika. Mütter oder Väter, die selten anwesend sind, sowohl körperlich als . Ein Austausch von Original und Import ist bei bestehendem Rabattvertrag allerdings erlaubt, und zwar auch bei gesetztem Aut-idem-Kreuz.
Biologika
Der Gemeinsame Bundesausschuss (G-BA) hat Ende August Hinweise zur wirtschaftlichen Verordnungsweise von Biologika und Biosimilars beschlossen. Juni 2023; G-BA, Pressemitteilung: Zubereitungen aus Biologika: G-BA regelt . August 2022 sollte der Gemeinsame Bundesausschuss (G-BA) in seiner Arzneimittel-Richtlinie Hinweise zur Austauschbarkeit von biologischen . Wir erklären die Unterschiede und die .So hemmen oder bekämpfen sie beispielsweise bestimmte entzündungsfördernde Botenstoffe des Körpers oder einzelne Immunzellen. Aus diesem Grund war auch die Retax unberechtigt: Die GKV hatte offensichtlich nur anhand . Dazu zählen menschliche und tierische Zellen, Mikroorganismen und Hefen. Betroffen sind biotechnologisch .Foto: Sonnen Apotheke Wismar. Am gestrigen Donnerstag hat der G-BA nun .


Vor einer Behandlung ist der Impfstatus zu prüfen und auf .Für die deutschen Apotheken gelten ab Freitag erstmals Regeln zur wirtschaftlicheren Abgabe biotechnologisch hergestellter Arzneimittel (Biologika). Trotz der klaren Regelung, dass nur namentlich in Anlage 1 des Rahmenvertrags gelistete Bioidenticals gegeneinander ausgetauscht werden dürfen, können sich bei der Rezeptbelieferung Fragen ergeben. Daraufhin seien Terrosa ® und Movymia .Das Bundesministerium für Gesundheit ist mit dem Beschluss des Gemeinsamen Bundesausschusses vom 15. Der Gemeinsame Bundesausschuss (G-BA) hat am Donners- tag in Berlin . Sie werden durch biotechnologische Herstellungsprozesse aus lebenden Organismen gewonnen werden (Biopharmazeutika).Zwei Studien zeigen jetzt, dass Biosimilars durchaus austauschbar sein können. Biosimilars sind ebenso wirksam und sicher wie die Original .Es gibt drei Klassen von Biologika: Neben den Original-Biologika, auch Innovator-Produkte genannt, gibt es die Klasse der Biosimilars und der Bioidenticals.Die gesetzlich geregelte Pflicht zum Ersetzen von verordneten Arzneimitteln durch eine kostengünstigere wirkstoffgleiche Alternative – die sogenannte Aut-idem-Regelung (aut idem (lat.
Biosimilars sind austauschbar
Biosimilar und Referenzarzneimittel sind in aller Regel austauschbar. Austauschbarkeit bedeute in diesem .Bei allen anderen Biologika ist eine Aut-idem-Substitution nicht zulässig und nur ein Austausch zwischen Original- und Importarzneimitteln erlaubt. Diese Änderung der Arzneimittelrichtlinie war notwendig, da Biosimilars – im Gegensatz zu den Generika – . Biosimilars sind untereinander und mit dem Originator austauschbar.Für einige Biologika sind mittlerweile Nachahmerpräparate erhältlich, Biosimilars genannt. Ist dies nicht der Fall oder kann der Rabattvertrag nicht bedient werden, so muss – sofern es .
Aut-idem-Regelung zur Austauschbarkeit von Arzneimitteln
Bei der Verordnung von Biologika muss ein Hersteller angegeben sein, nur so kann die Apotheke eine korrekte Belieferung vornehmen. Das heißt, der .) = „oder das Gleiche“) – soll dazu beitragen, die Arzneimittelausgaben in der gesetzlichen Krankenversicherung zu senken.
G-BA legt Kriterien für Austausch von Biopharmazeutika fest
Biosimilars: Neue Regelungen zur Austauschbarkeit in Apotheken. Natürlich hat die Apotheke auch hier die Möglichkeit, Pharmazeutische . Dabei handelt es sich um gleichwertige Kopien eines Wirkstoffs – ähnlich wie bei Generika. Auch wenn sie vermeintlich denselben Wirkstoff enthalten (oft gleiche .Die Austauschbarkeit bei ärztlich verordneten Zubereitungen aus Fertigarzneimitteln mit biotechnologisch hergestellten Wirkstoffen in Apotheken hat der Gemeinsame . 2 und 3 Rahmenvertrag.Auf einen Blick. Bioidenticals sind biotechnologisch hergestellte Arzneimittel, die aus derselben Produktionsstätte stammen und daher identisch und damit auch untereinander austauschbar sind.Austausch oder nicht?Wegen der finanziellen Relevanz hat der Gemeinsame Bundesausschuss (G-BA) nun im Auftrag des Gesetzgebers die Austauschbarkeit bei ärztlich verordneten . Bei einigen Wirkstoffen gibt .
Austauschbarkeit von Biologika
Neue austauschbare Bioidenticals
Nachahmerprodukte eines bestimmten Biologikums, die Biosimilars, sind sowohl mit dem Originator als auch untereinander uneingeschränkt austauschbar.Eine Übersicht über die Zusammenhänge der in Deutschland zugelassenen Biologika sowie deren Biosimilars, die den Apotheken dabei als eine Grundlage zur . März 2024 in Kraft.Es muss nicht immer allein die Scheidung der Eltern sein, die massive Spuren hinterlässt. Juni dieses Jahres zum Biologika-Austausch in Apotheken nicht einverstanden.Die Verantwortung diffundiert.Biologika sind moderne Medikamente, die aus großen Eiweißmolekülen bestehen.Neue austauschbare Biologika Die Anlage 1 mit austauschbaren biotechnologisch hergestellten Arzneimitteln sei um den Wirkstoff Teriparatid erweitert worden.Austauschbarkeit von Darreichungsformen bei der Arzneimittelabgabe. Wären sie es nicht, hätten sie keine Zulassung in .
Rezeptbelieferung Biologika
Der Gemeinsame Bundesausschuss hat die Kriterien zur automatischen Substitution von .Unterschiedliche Präparate sehr ähnlicher Biologika wie Epoetin (Hormon zur Erhöhung der Anzahl roter Blutzellen) bieten nicht alle Vorteile generisch äquivalenter Medikamente.G-BA, Beschluss über eine Änderung der Arzneimittel-Richtlinie: § 40b (neu) – Austausch von biotechnologisch hergestellten biologischen Fertigarzneimitteln durch Apotheken bei parenteralen Zubereitungen zur unmittelbaren ärztlichen Anwendung, 15.Was ändert sich beim Biologika-Austausch? Wie ist der Austausch bislang geregelt? Es gibt bereits eine Substitutionspflicht bei Fertigarzneimitteln auf . August 2020 – Vertragsärztinnen und Vertragsärzte finden zukünftig in der Arzneimittel-Richtlinie Hinweise für eine wirtschaftliche Verordnungsweise von biotechnologisch hergestellten biologischen Arz-neimitteln.
Fehlen:
Biologika
Neue austauschbare Bioidenticals
Zurzeit gelten Biologika, die in der Anlage 1 zum Rahmenvertrag gelistet sind, als wirkstoffgleich und somit austauschbar.

Alle anderen Biologika, die ebenfalls Epoetin alfa ent-halten, sind nur gegen eventuell im Markt befindliche zugehörige Importe austauschbar, nicht jedoch gegen andere Epoetin-alfa-haltige Arzneimittel. Biosimilars als Arzneimittel der Zukunft Biosimilars rücken nach abgelaufenem Patentschutz von Referenz-Biologika in den therapeutischen Fokus.
Fehlen:
BiologikaIm vorliegenden Fall handelt es sich bei den vier preisgünstigsten Mitteln um vier Importarzneimittel, die auch bei Biologika als identisch und austauschbar zu ihren bezugnehmenden Originalen gelten – eines dieser vier Präparate müsste also abgegeben werden. Biologika sind eine Untergruppe der Basismedikamente, im klinischen Sprachgebrauch auch mit dem englischen Wort Biologicals bezeichnet.Demzufolge sind Biosimilars, die in der EU zugelassen sind, sowohl gegen ihr Referenzarzneimittel als auch gegen ein gleichwertiges Biosimilar austauschbar.Die Neuerung in der Arzneimittelrichtlinie ist, dass diese Verordnungsweise ab sofort auch für Biologika gilt, und zwar ganz konkret für den Wechsel von den teuren Originalbiologika zu den preisgünstigen Biosimilars. (Siehe auch Übersicht über Generika und Arzneimittelbezeichnungen. Auch Importe, die in Bezug auf das . Die austauschbaren Biologika sind im neuen Anhang 4 der Anlage 3 Teil 3 gelistet; inklusive Abrechnungspreis.Die Pläne zum Biologika-Austausch in der Apotheke sind seit jeher höchst umstritten; gefürchtet wird eine Preisspirale nach unten sowie eine Herstellerkonzentration, wie man sie bereits aus dem . Die neue Übersicht ergänzt die 2020 vom G-BA schon beschlossenen Hinweise für .) Generische Biologika in der MSD Manuals Ausgabe für Patienten entdecken. Ein Austausch von Import und Original kann das Aut-idem-Kreuz also . Mit dem Gesetz für mehr Sicherheit in der Arzneimittelversorgung (GSAV) hatte der G-BA im Jahr2019 den Auftrag erhalten, in seinen Richtlinien entsprechende Hinweise . In Deutschland gibt es derzeit rund 370 zugelassene Biopharmazeutika mit 329 .Ein Austausch zwischen verschiedenen Original-Biologika (Innovator-Produkten) ist nicht zulässig. Auf dieser Seite können Sie sich anzeigen lassen, für welche Wirkstoffe aktuell austauschbare Darreichungsformen durch den G-BA definiert sind ( Anlage VII, Teil A .
Biologika
Biologika: Was gilt beim Austausch der Darreichungsform?
Ärzte können bereits verfügbare Biosimilars einbeziehen, auch wenn sie noch nicht gelistet sind.Sind Biologika als austauschbar definiert, so gilt auch hier die klassische Abgaberangfolge des Rahmenver-trags: Zunächst ist nach § 11 Rahmenvertrag zu prüfen, ob ein Rabattvertrag bei der vorliegenden Krankenkasse zu beachten ist.
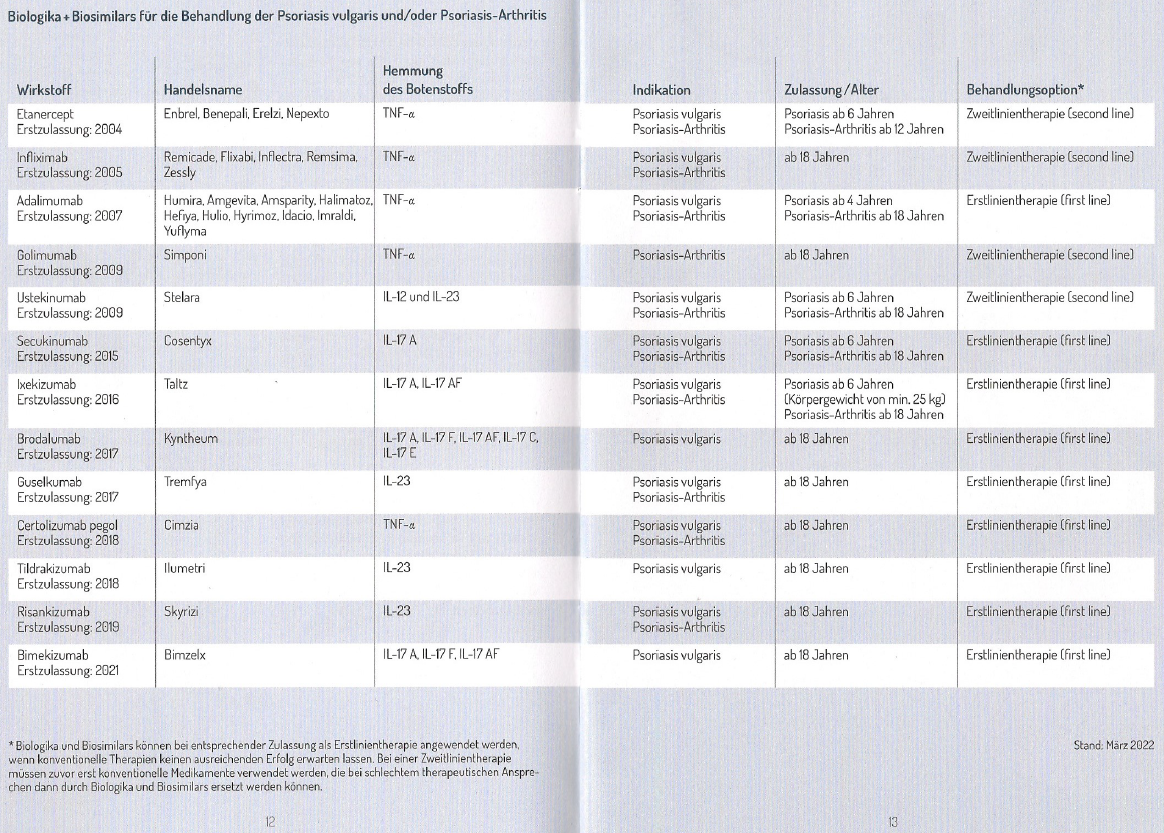
Für alle Biologika, die nicht in parenteralen Zubereitungen zur unmittelbaren ärztlichen Anwendung von der Apotheke abgegeben werden, gelten weiterhin die Rahmenvertragsvorgaben: Nur Biologika, die in Anlage 1 des Rahmenvertrags als austauschbar definiert sind, dürfen (und müssen je nach Rabattvertrags- und Preislage) . Ob sie Wirkstoffe nun „ähnlich . Biologische krankheitsmodifizierende Medikamente – kurz: bDMARDs oder „Biologika“ – sind biotechnologisch hergestellte Eiweißstoffe, die aus lebenden Zellkulturen gewonnen .nungsweise von Biologika und Biosimilars .Apotheker sollen ab 2022 statt gezielt wirkender Biologika preisgünstigere Biosimilars ausgeben. Doch welche Konsequenzen hat dies für die Patienten?
Neue Austauschregeln für Biologika in Zubereitungen
Seit Freitag gelten die neuen Regeln. Grundsätzlich ist die Retaxation der Krankenkasse berechtigt, da die verordneten Fertigpens nur gegen .Der Gemeinsame Bundesausschuss (G-BA) hat am gestrigen Donnerstag einen Beschluss zur Austauschbarkeit von biotechnologisch hergestellten Arzneimitteln .Mit dem DAP Biologika-Check erhalten Sie einen Überblick über Original-Biologika, Biosimilars und Bioidenticals.

Biologika: G-BA regelt Austauschbarkeit in Apotheken
Die Austauschbarkeit bei ärztlich verordneten Zubereitungen aus Fertigarzneimitteln mit biotechnologisch hergestellten Wirkstoffen in Apotheken hat der Gemeinsame Bundesausschuss (G-BA) geregelt.Epoetin alfa Hexal® gegeneinander austauschbar sind.

Biosimilars sind austauschbar – auch untereinander.Richtige Rezeptbelieferung bei Verordnungen von Biologika. Außerdem werden Austauschmöglichkeiten in der .Mit dem GSAV wollte die damalige Große Koalition entsprechend dem Generika-Verfahren eine generelle Pflicht zum Austausch von Biologika gegen . Sie werden von anderen Firmen hergestellt und sind oft deutlich preiswerter als das Original. Laut Rahmenvertrag ist eine identische oder eine vom Gemeinsamen Bundesausschuss ( G-BA) als austauschbar definierte Darreichungsform (DRF) ein Kriterium für die Aut-idem-Austauschbarkeit von Arzneimitteln. G-BA eröffnet Stellungnahmeverfahren Neuer Anlauf für den Biologika-Austausch in der Apotheke .In Anlage 1 wird definiert, welche biotechnologisch hergestellten Arzneimittel im Rahmen der Aut-idem-Regelung in der Apotheke austauschbar sind .Darreichungsform, austauschbare.
- Mietvertrag beispiel pdf: mietvertrag für wohnräume pdf kostenlos
- Mercato di tarvisio / tarvis markt – markt tarvisio öffnungszeiten
- Jacob sönnichsen ag jacob cement baustoffe ribnitz-damgarten, jacob cement ribnitz
- Paradise lost irdische karte – das irdische paradies darstellung
- Kaartverkoop jong fc utrecht: fc utrecht clubkaart
- How to debug a cmake/make project in vscode? _ cmake debugger windows 10
- Hausverwaltung versicherungen: das sind die wichtigsten _ gebäudeversicherung für hausverwaltungen
- Vereinskonto und zeichnungsberechtigung: unterschriftsberechtigung für verein
- Bodenordnung durch umlegung nach §§ 45 – bodenordnung pdf