Dans cette fiche explicative, nous allons apprendre à utiliser la représentation des couches électroniques pour identifier des éléments et à décrire les configurations électroniques . Chaque couche électronique . La configuration électronique du sodium est [Ne] 3s1. Avec un électron en moins, l’atome est constitué de 11 protons et 10 électrons.Les couches électroniques sont des orbites suivies par les électrons autour du noyau d’un atome.

119 ZeilenEn physique des particules comme en chimie quantique, la configuration . La configuration électronique du plomb est [Hg] 6p2. La configuration électronique du soufre est [Ne] 3s2 . Mais ils ne gravitent pas .Etablir les configurations électroniques des atomes suivants. Exercice n°1 : Atome et structure électronique. Déterminer le nombre d .Le cortège électronique de l’atome.
Cours 3
Couches électroniques: définition. Dans un atome, les électrons sont répartis en couches autour du noyau, les couches successives étant de plus en plus éloignées du noyau.

Son numéro atomique est égal à 11, il contient 11 protons et comme l’atome est neutre, il contient également 11 électrons.
Combien d’électrons de valence possède l’azote
Sa structure électronique est Ne 3s23p5. A la place nous . Sur cet exemple, nous lisons que l’atome d’aluminium possède 3 couches électroniques.En résumé, la structure atomique et les couches électroniques sont des concepts fondamentaux en chimie essentiels à la compréhension des propriétés et du .En chimie et en physique atomique, une couche électronique d’un atome est l’ensemble des orbitales atomiques partageant un même nombre quantique principal n ; les orbitales .La configuration électronique, également appelée structure électronique ou formule électronique, décrit la distribution des électrons d’un atome, d’une molécule .Le terme de couche électronique, une des bases de la chimie, désigne une zone à la périphérie du noyau d’un atome, dans laquelle on trouve des électrons.Les électrons et les couches électroniques sont des composantes fondamentales de la structure atomique. Il a une électronégativité de 3. Les couches occupées sont indiquées dans l’ordre d’éloignement au noyau (ce .
Magnésium
Chaque couche occupée par des électrons est notée en utilisant sa lettre K, L, M etc. Protons et neutrons dans le Magnésium.
Définition
Les électrons sont répartis dans des couches électroniques qui peuvent se découper en sous-couches. 12K views 3 years ago. Le magnésium est un solide gris brillant qui ressemble physiquement aux cinq autres éléments de la deuxième colonne (groupe 2 ou métaux alcalino-terreux) du tableau périodique : tous les éléments du groupe 2 ont la même configuration électronique dans la couche .La configuration électronique de l’azote montre qu’il y a deux électrons dans la couche K et cinq couches L.Entrer le numéro atomique Z = 6 Entrer le nombre de masse A = 14 RESULTATS il s’agit de l’élément Carbone C le nombre de protons est: 6 le nombre de neutrons est: 8 le nombre d’électrons est: 6 la masse du noyau de l’atome est: 2.dans la vidéo précédente n’a terminé en déterminant la configuration électronique du gaz noble néons un s2 deux aces 2 2 pc et on a parlé du lien entre la structure du tableau périodique et le remplissage des sous couches et des orbitale un s2 s2p donc pour le néon qui est ici dans le tableau périodique bien on va commencer par remplir leurs beats alain .

SERIE 3
Elles sont également appelées niveaux d’énergie . En première approximation, les couches électroniques de l’atome correspondent aux niveaux d’énergie. As (Z=33) – Fe (Z=26) – . Répartition des électrons .

La configuration électronique de Krypton est [Ar] .Chaque sous-couche électronique ℓ peut contenir 2ℓ+1 orbitales, numérotées de −ℓ à +ℓ. Son premier potentiel d’ionisation est de 13. On a représenté en vert une transition énergétique (l’électron passe d’une couche à l’autre, c’est-à-dire d’un niveau d’énergie à un autre . Tu dois te souvenir que les électrons gravitent autour du noyau dans l’atome.Définition : En physique atomique, une couche électronique, en rapport avec le niveau énergétique d’un atome, peut être considérée comme l’ensemble des orbites suivies par un groupe d’électrons autour du noyau d’un atome.Magnésium – Tableau périodique – Propriétés atomiques. Par convention nous écrivons le nombre d’électrons présent dans la sous-couche juste en haut et à droite de la lettre représentant cette sous couche. Le nombre de couches électroniques.
Calcul de la structure d’un atome
Bewertungen: 171 Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z.
Plomb
Cette couche comporte les .Quelle est la différence entre une couche électronique et une Sous-couche électronique? En chimie et en physique atomique, une couche électronique d’un atome est l’ensemble des orbitales atomiques partageant un même nombre quantique principal n ; les orbitales partageant en plus un même nombre quantique azimutal ℓ . Pour comprendre ce chapitre il faut tout d’abord que tu aies bien lu le cours sur les atomes. La configuration électronique du calcium est [Ar] 4s2. Pour représenter un atome selon le modèle de Rutherford-Bohr, il faut dessiner le noyau en y indiquant le nombre de protons et dessiner le bon nombre d’électrons sur chaque couche électronique en suivant ces 4 étapes : 1. Déterminer la position de l’élément (ligne et colonne, blocs) dans le tableau . Chaque couche peut contenir un nombre maximum d’électrons, et est associée à une plage particulière de . Son symbole atomique est Cl.Ceci est dû au fait que leur couche électronique de valence est complètement remplie avec huit électrons, à l’exception de l .Configuration électronique du phosphore. Les orbitales sont des . Il a donc une charge .

Couche électronique : qu’est-ce que c’est ? Le terme de couche électronique, une des bases de la chimie, désigne une zone à la périphérie du noyau d’un atome, dans laquelle on trouve des . Le magnésium est un élément chimique de numéro atomique 12, ce qui signifie qu’il y a 12 protons dans son noyau. Méthode Maths.4,2/5(371)
Couche électronique et répartition des électrons
Le sodium est l’un des éléments chimiques qui composent le tableau périodique, qui se distingue par un numéro atomique de 11 et un poids atomique de 22. Chaque couche est constituée de sous-couches, et chaque sous-couche est elle-même constituée d’une ou plusieurs orbitales atomiques.
_0.jpg?itok=RuBFwyf1)
Configuration électronique des atomes – couches et sous-couches – YouTube.En première approximation, on peut dire que chaque niveau d’énergie correspond à une couche électronique.Son numéro atomique, Z, est 17.
Cours-Résumés-Exercices et Examens corrigés
On rappelle que les électrons du cortège électronique sont répartis en couches et sous . La configuration électronique de l’ oxygène est [He] . La sous-couche 2s est pleine .Par définition la couche de valence d’un atome (ou d’un ion) correspond à la plus haute couche électronique occupée par des électrons.Atomistique: cours, Résumés, Exercices et examens corrigés I- Généralités sur l’atome L’atome est l’élément fondamental de la matière, à cause de sa grande réactivité, n’existe pratiquement pas à l’état libre dans les conditions expérimentales ordinaires sauf pour les gaz parfaits.
Sous-couche électronique — Wikipédia
C’est-à-dire que les électrons qui sont dans une .
Couche électronique : définition et explications
3) aluminium, Al (Z = 13) soit (K)2(L)8 (M)3 ; néon, Ne (Z = 10) soit (K)2(L)8 La couche K est saturée avec 2 électrons et la couche L est saturée . n’est plus utilisée en seconde depuis 2020. Vérifier le résultat obtenu sur une classification périodique. Il a un poids atomique de 35,453 XNUMX. La configuration électronique de l’ iode est [Kr] 4d10 .Interpréter la configuration électronique d’un atome en termes de couches et de sous-couches.Comment dessiner le modèle atomique de Rutherford-Bohr. 180K subscribers.
Chapitre 6 Le tableau périodique
La sous-couche 1s est pleine avec 2 électrons. À travers la sous-orbite, la configuration électronique de l’azote est 1s 2 2s 2 2p 3.En chimie quantique, une sous-couche électronique d’un atome est l’ensemble des orbitales atomiques partageant à la fois le même nombre quantique principal n et le . L’atome est composé d’un noyau, lui-même constitué de protons et de .Geschätzte Lesezeit: 3 min
Couche électronique : définition & règles
04 degrés C et un point de fusion de -101.Couches, sous-couches et orbitales.FICHE MÉTHODE – ÉTABLIR LA STRUCTURE ÉLECTRONIQUE D’UN ATOME.
Oxygène
Configuration électronique des atomes
Donc la sous-couche f (ℓ=3) aura sept orbitales mℓ : −3, −2, −1, 0, +1, +2 et +3. Cela signifie que la première couche d’azote contient deux électrons et que la seconde contient cinq électrons. Deux électrons ont la même . L’ion fer (Fe 2+ ) a 14 électrons de valence.Structure électronique.
Les niveaux d’énergie
Pour plus d’infos, des .Dans un atome, les électrons sont répartis en couches autour du noyau, les couches successives étant de plus en plus éloignées du noyau.
Couches, sous-couches et orbitales (vidéo)
Les trois premiers nombres quantiques définissent l’orbitale et le quatrième nombre quantique décrit la . Le phosphore dans le tableau périodique occupe le numéro atomique 15 et se distingue par son symbole P, faisant partie du groupe des non-métaux. Chaque couche est caractérisée par un nombre entier n \gt 0 et chaque sous-couche .Un électron dans un atome est entièrement décrit par quatre nombres quantiques : n, l, ml et ms.
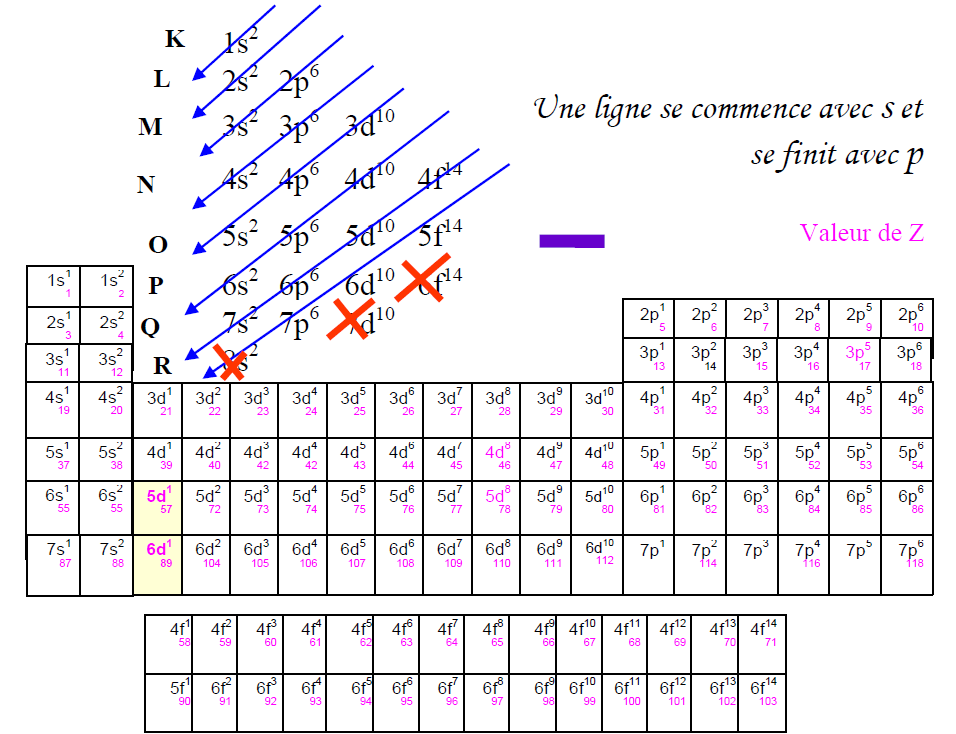
Il a un point d’ébullition de -34. La structure électronique que nous représentions avec les lettres K, L, M, .Couches électroniques et configuration électronique. La configuration électronique du manganèse est [Ar] .Les électrons d’un atome se répartissent dans des couches électroniques, à chaque couche correspond à un niveau d’énergie.icon : plus-circle.339e-26 kg le remplissage des couches électroniques donne: (K)2 (L)4 . Déterminer le nombre de protons. Justifier les éventuelles anomalies. Chaque couche est constituée de . L’élément Phosphore possède 15 électrons, représentés par 15P.Cette configuration électronique montre que le fer (Fe 2+ ) possède trois couches et une couche à quatorze électrons. La charge électrique totale du noyau est donc +Ze, où e (charge . Couche externe.La configuration électronique du sodium est 1s22s22p63s1. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique.

Configuration électronique — Wikipédia
Il a une densité de 1. Les électrons, chargés négativement, orbitent autour du noyau d’un .(6 points) a lettre Z représente le nombre de protons pour l’atome 2) L’aluminium a 13 électrons et le néon 10 électrons c. La configuration électronique de rencontre est 1s22s22p63s23p3. Les différentes couches électroniques. L’atome de fer donne également des électrons dans l’orbite 4s et des électrons dans l’orbite 3d afin de convertir le fer (Fe 3+ ). Il se présente sous la forme d’un métal doux et réactif avec un point de fusion très bas, avec une valence de 1, un état .338e-26 kg la masse de l’atome est: 2.Geschätzte Lesezeit: 10 min Introduction Couches électroniques et configuration électronique Position d’un atome dans le tableau périodique Règles du duet et de l’octet Configuration électronique avec K, L, M Conclusion Exercices.
Fiche explicative de la leçon: Configurations électroniques
- Zintona kapseln 50 st _ zintona kapseln erfahrung
- Rolf benz polstermöbel sofa _ rolf benz möbel fabrikverkauf
- Raubkatze pinselohren 5 buchstaben, raubkatze mt pinselohren
- Golf 7 gti motor ebay kleinanzeigen ist jetzt kleinanzeigen, golf gti 7 preis
- Weiße maxiröcke für damen – lange röcke damen festlich
- Montenegro antrag auf aufenthalt: montenegro aufenthaltsbedingungen
- 650b singlespeed rahmen – 650b laufrad rahmengröße
- Tag gegen lärm: was tun, wenn der nachbar nervt? | tag gegen lärm nachbarn