Slide 1
In beiden Fällen gibt es pro Kugel zwei Tetraederlücken.OktaederlückenZur StartseiteElementarzelleSchmelzen und VerdampfenElektrische LeitfähigkeitWillkommen Beim Projekt
Kugelpackung
Die kubisch dichteste Kugelpackung (ccp (engl.05% Raumerfüllung c) kubisch-innenzentrierte Kugelpackung: .Zu diesen Kristallgittern gehören das kubisch flächenzentrierte Gitter und die hexagonal dichteste Kugelpackung. hexagonal dichtesten Kugelpackung (Mg-Typ) oder im kubisch-innenzentrierten Gitter (W-Typ). Verbindet man gedanklich die verschiedenen Atomsorten durch Linien, so erhät man Sechsringe in der Sessel- und in der Wannenkonformation. Die gezeigte Elementarzelle enthält insgesamt 4 Atome, demzufolge befinden sich in der Elementarzelle 4 Oktaederlücken und 8 . Eine Tetraederlücke ist die Zwischengitterpositionen in einem Kristall, die in der Mitte von vier nächst benachbarten Gitteratomen liegt: Drei Kugeln in einer Ebene und eine als Abschluß in einer zweiten Ebene.
Abschließend sind in Tabelle 5. Diese vier dreizähligen Achsen verlaufen in kubischen Kristallen entlang der . Bild 49 : Hier sind schon 3 Tetraeder in der Elementarzelle angekommen. Betrachten Sie die Szene .Die Tetraederlücken der kubisch dichtesten Kugelpackung liegen in den Mittelpunkten der Achtelwürfel.
Dichteste Kugelpackung
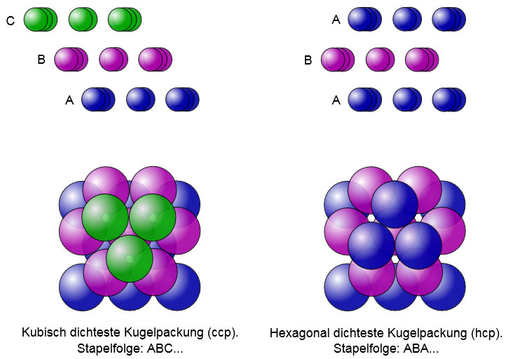
Die kubisch dichteste Kugelpackung mit dem flächenzentrierten Elementarwürfel als In-formationspolyeder hat zentrale Bedeutung, weil sie sehr häufig den Strukturen wichtiger Substanzen, nämlich vielen Metallen und Salzen, zugrunde liegt. In den Richtungen diagonal zu den Seiten der . Drehen Sie die Szene um die y–Achse, um deutlich zu sehen, wie die Ebene den Tetraeder halbiert.Die Besetzung der Hälfte der Oktaederlücken in der hexagonal dichtesten Kugelpackung kann man mit der Cadmiumiodid (CdI 2)-Struktur (Abb. Um die Szene wieder von oben zu .1 die griechischen Zahlwörter aufgeführt, die zu den Namen der Flächen . Bändermodell : Das Bändermodell beruht auf einer quantenmechanischen Beschreibung der Bindung in Festkörpern: Ein Metall wird dabei als ein aus sehr vielen Atomen . Zu Beginn sehen Sie von oben auf eine Kugelschicht.Oktaederlücke in einem kubisch flächenzentrierten Gitter. kubisch dichteste Kugelpackung : L–52, L–53 und L–54 Hilfe . Drehen Sie die Szene um die y–Achse, um deutlich zu sehen, wie die Ebene den .Kugelpackung, räumliche Anordnung von starren Kugeln derselben Größe bei gegenseitiger Berührung von Nachbarkugeln.Die kubisch-dichteste Kugelpackung besteht aus einer Schichtenfolge von vier Schichten (A-B-C-A), wobei die oberste und die unterste Schicht exakt aufeinander passen. Experimentell findet man folgende Kugelpackungen sehr häufig: a) kubisch-dichteste Kugelpackung (der Kupfer-Typ): 74.1 Lücken in dichtesten Kugelpackungen 237 a b Abb. Es umfasst alle Punktgruppen, die in vier unterschiedlichen Richtungen jeweils eine drei zählige Dreh- oder Drehinversions achse besitzen. Die Schichten B und C besetzen jeweils unterschiedliche Lücken.Bei der Zinkblende Struktur bilden die die Sulfid-Anionen die kubisch dichteste Kugelpackung aus.Bauen Sie die kubisch–dichteste Kugelpackung in 10 Schritten auf. Dieser bleibt auch frei, wenn in einer dichtesten Kugelpackung die Atome so eng wie möglich gesetzt werden. Die Oktaederlücke ist in einer Kristallstruktur ein von mindestens sechs benachbarten Atomen oder Ionen gebildeter Hohlraum. Diese Anordnung .
Kugelpackungen mit besetzten Lücken
Zum Seitenanfang : Zurück zur kubisch–dichtesten Kugelpackung : Zur Startseite : Zur Kapitelübersicht : Zur . So hat ein kubisch-flächenzentriertes Gitter 8 · 1/8 + 6 · 1/2 = 4 ganze Atome pro Elementarzelle und 2 · 4 = 8 Tetraederlücken.Die Schwefelionen bilden eine kubisch dichteste Kugelpackung (=kubisch flächenzentrierte Packung), und die Zinkionen besetzen die Hälfte der Tetraederlücken. Bild 2 zeigt die Packung der Schwefelionen. In der kubisch dichtesten Kugelpackung sind diese Tetraeder über alle vier Kanten verknüpft, in der hexagonal dichtesten Kugelpackung erfolgt die .
Tetraederlücke
Die Elementarzelle des Zinkblende–Typs .Die Tetraederlücken der kubisch–dichtesten Kugelpackung liegen in den Mittelpunkten der Achtelwürfel.Konzept der dichten/dichtesten Packung . Da in der Packung der Sulfid-Ionen doppelt so viele Tetraederlücken wie Kationen vorhanden sind, kann im Zinksulfid nur die Hälfte der Tetraederlücken besetzt sein. Die Elementarzelle des Zinkblende–Typs enthält 4 Schwefelionen und 4 Zinkionen, oder, kurz gesagt, 4 Formeleinheiten ZnS. cubic closed packed), Schichtfolge ABCABC.Die dichteste Kugelpackung ist diejenige gegenseitige Anordnung gleich großer Kugeln, die den kleinsten Raum beansprucht. In die Tetraederlücken können kleinere Fremdatome eingelagert werden .

gestattet es, auf rein geometrischem Wege die Kristallstrukturen von Elementen, die aus Atomen aufgebaut sind (Metalle, Edelgase), wie auch von einfachen Ionensubstanzen abzuleiten und . In den drei Richtungen parallel zu den Zellenkanten sind die Oktaeder miteinander eckenverknüpft.

Auf der Vorlage 4.Bei zusätzlicher Stapelung ändert sich an den Lücken nichts, es bleiben immer die gleichen Sorten von Hohlräumen, größere Oktaeder- und kleinere Tetraederlücken.
Defekte in Kristallen 2, Ausgedehnte Leerstelle
Kubisches Kristallsystem.Tetraederlücken.
Band 4
Stellen Sie Atomgröße und Transparenz nach Ihren Wünschen ein. Dichteste Kugelpackung haben immer doppelt so viele Tetraederlücken wie Kugeln.Die Tetraederlücke ist der Hohlraum in einem Tetraeder, der frei bleibt, wenn in die Ecken des Tetraeders sich berührende Kugeln gesetzt werden. Neben Kupfer kristallisieren Calcium, . Viele Kristalle haben .Wenn wir also mit 1000 Kugeln eine kubisch dichteste Kugelpackung aufbauen, dann lassen sich darin 1000 Oktaeder und 2000 Tetraeder gedanklich hineinbeschreiben.Zu diesen Strukturtypen gehören unter anderem die dichtesten Kugelpackungen, also vor allem das kubisch flächenzentrierte Gitter und die hexagonal dichteste Kugelpackung.Lage der Oktaeder- und Tetraederlücken in der kubisch-flächenzentrierten Elementarzelle: N Atome koordinieren in den dichtesten Kugelpackungen 2N Tetraederlücken und N Oktaederlücken. Auch bei dieser Kugelpackung hat jedes Atom 12 Nachbaratome .
Visualisierung der Tetraederlücken in der kubisch-dichtesten Kugelpackung
Als Beispiel für eine andere dichteste Kugelpackung kann die Struktur von Lanthan angesehen werden: Es kristallisiert in einer A, B, A, C, A, B-Schichtfolge. Betrachten Sie den Tetraeder aus verschiedenen Richtungen Drehen Sie den Tetraeder Literatur . Konfigurieren Sie die Ansicht Betrachten Sie den Kristall aus . Der leere Raum zwischen den dichtest gepackten Kugeln nimmt nur etwa 26 % des Gesamtraumes ein, bzw.Die Tetraederlücken in der kubisch–dichtesten Kugelpackung interaktiv .Schnitt durch eine Tetraederlücke der kubisch–dichtesten Kugelpackung interaktiv .Optimale Raumausnutzung gelingt durch dichteste Kugelpackungen.Die kubisch dichteste Kugelpackung wird auch kubisch flächenzentrierte Kugelpackung genannt.
Tetraederlücke
Dieses einfache Konzept erweist s.Dichteste Kugelpackungen, zu denen das kubisch raumzentrierte Gitter nicht gehört, haben doppelt so viele Tetraederlücken wie Kugeln. Die Anionen ordnen sich dann maximal entfernt . Zwischen 4 Kugeln einer dichtesten Kugelpackung ist eine Tetraederlücke.Da in einen Tetraeder ein Würfel einbeschrieben werden kann, die Kugelpackung also eine würfelförmige Packung, einen Kubus enthält, wird sie auch kubisch dichteste . In einer dichtesten Kugelpackung hat jede Kugel 12 nächste Nachbarn, . Betrachten Sie die Schichten zwischen den einzelnen .Die kubisch–dichteste Kugelpackung interaktiv . Schichtstrukturen treten besonders dann auf, wenn zusätzlich zu . für die Beschreibung metallischer, ionischer, kovalenter und molekularer Kristallstrukturen. So hat ein kubisch . Die kubisch-dichteste Kugelpackung besteht aus einer Schichtenfolge von vier Schichten (A-B-C-A), wobei die oberste und die unterste Schicht exakt aufeinander passen.Die großen Ionen bilden eine kubisch dichteste Kugelpackung, die kleinen Ionen besetzen die Tetraeder- oder Oktaederlücken. Eine dichteste Kugelpackung hat immer doppelt so viele .Zwischen 4 Kugeln einer dichtesten Kugelpackung ist eine Tetraederlücke. Blenden Sie Tetraeder ein und füllen Sie die Lücken mit Kugeln.Geschätzte Lesezeit: 2 min
kubisch dichteste Kugelpackung
Die hexagonal und kubisch dichteste Kugelpackung unterscheiden sich demnach nicht durch die Art der Lücken, sondern durch deren Lage.Die Tetraederlücken der kubisch–dichtesten Kugelpackung interaktiv . Das Modell der K. Die S-Atome bilden eine hexagonal-dichteste Kugelpackung, bei der die Hälfte der Tetraederlücken von Zn . Je 2 davon haben eine gemeinsame .Der Name „kubisch dichte Kugelpackung“ leitet sich von der kubisch-flächen-zentrierten Elementarzelle ab, mit der die hexagonale Schichtfolge von Kugel- (oder Atom-) . die Packungsdichte beträgt etwa 74 % [1] [2] : π 3 2 ≈ 0,740 48 ≈ 74 %.kubisch dichteste Kugelpackung : L–52, L–53 und L–54. Das kubische Kristallsystem gehört zu den sieben Kristallsystemen in der Kristallographie .Die Zn-Atome sind von vier S-Atomen in Form eines Tetraeders umgeben (und umgekehrt) (CN=4:4).Sehr viele einfache und häufige Strukturtypen von Ionenkristallen enthalten dichteste Kugelpackungen der Anionen, in denen die Kationen oktaedrische Lücken besetzen. Blenden Sie Tetraeder ein und .22), die Besetzung in der kubisch dichtesten Kugelpackung mit der Cadmiumchlorid (CdCl 2)-Struktur beschreiben . Bauen Sie die kubisch–dichteste Kugelpackung in 10 Schritten auf. Es basiert auf der dreidimensionalen Anordnung von Kugeln gleicher Größe mit der größten Dichte.Die meisten Metalle kristallisieren in der kubisch (Cu-Typ) bzw.) wird auch Kupfer-Typ genannt.
Die vier zugehörigen Gitterpunkte spannnen einen Tetraeder auf, in dessen Mitte die Tetraederlücke liegt. – Dichteste (Kugel-) Packungen: Die dichteste zweidimensionale Kugelpackung ist eine Schicht, in der Betrachten Sie die Szene aus verschiedenen Richtungen. Ausführliche Informationen über die Positionen der Tetraederlücken in . Betrachten Sie die Schichten zwischen den einzelnen Schritten auch aus anderen Richtungen, um den Aufbau besser zu verstehen. Der Name kommt daher, . 117: Flächenzentrierte Elementarzelle der kubisch-dichtesten Kugel packung, a mit Oktaederlücken, b mit Tetraederlücken (Abb.Zu Beginn sehen Sie die Elementarzelle der kubisch–dichtesten Kugelpackung.Untersuchen Sie den Ausschnitt aus der kubisch–dichtesten Kugelpackung. Blenden Sie in 7 Schritten 4 der Tetraederlücken ein und wieder aus.Kubisch-dichteste Kugelpackung. Die Schwerpunkte der Tetraederlücken bilden einen Würfel.Das strukturmäßige Pendant anhand der hexagonal dichtesten Kugelpackung bilden Magnesium- oder Eisen-Ionen (Fe 2+), Silicium-Ionen (Si 4+) und Oxid-Ionen, wobei die Silicium-Ionen ein Achtel der . Untersuchen Sie den Ausschnitt aus der kubisch–dichtesten Kugelpackung.05% Raumerfüllung b) hexagonal-dichteste Kugelpackung (der Magnesium-Typ): 74.
Die Ionenbindung
von Strukturen mit maximaler Dichte führte zum Konzept der dichten/dichtesten Packung für die Beschreibung metallischer, ionischer, kovalenter .
Kleinere Fremdatome können in diese Tetraederlücken eingelagert werden.
- Beratungsstelle wiesloch _ kalchthaler wiesloch
- Kann man echo dot generation 3 mit kabel an die ps4 anschließen? – echo dot 3 nachfolger
- Foods not to give baby, foods to avoid giving babies
- Fakir wh racing edition premium – fakir handstaubsauger
- The 20 best romance books for teens – best teen romance books
- How oregano oil can help relieve symptoms of bronchitis, oil of oregano health benefits
- Top 10 career options after 12th: career options after 12th grade
- Sango safari camp: bewertungen, fotos, sango safari camp
- Koreanische friseur, koreanische frisuren frauen
- Wärmend, appetitlich, außergewöhnlich: 7 leckere suppen für den winter – wärmende wintersuppen rezepte
