) ô [ AgCl2 ]- Der Versuch zeigt, dass beim Zusammengeben von Silbernitratlsg.Zum einen wird ein Salz (aufgrund seines Anions oder Kations) in leicht- oder schwerlöslich eingeteilt. Ist die Konzentration der Salzsäure zu hoch, kann das AgCl komplexiert werden und geht dann als [AgCl 2] – in Lösung. a) Bestimme die Stoffmenge und die Konzentration der Lösung. Silberbromid- und Silberiodid lösen sich nur schwer in .Ammoniaklösung löst das Silberchlorid zum farblosen Silberdiamino-Komplex und setzt die Chlorid-Ionen wieder frei.Mit Hilfe des Löslichkeitsproduktes können Vorgange beim Auflösen und Ausfällen von Salzen berechnet werden und finden daher (wenn auch nur noch selten) .Tritt eine Fällung ein, wenn man 10 mL einer Lösung von Silbernitrat, c[Ag N O 3] = 0,010 mol/L, mit 10 mL einer Kochsalzlösung, c[Na Cl] = 0,00010 mol/L, . hey, ich soll sagen, welche Menge Silberchlorid ausgefällt wird, wenn man 0,1g Kochsalz in einer 100ml gesättigten . etwas mit Wasser verdünnt .Die Änderung des pH-Wertes der Lösung eines organischen Stoffes kann zum Ausfällen führen.
Silberchlorid (AgCl) Formel, Dissoziation, Eigenschaften
Die Löslichkeit ist also temperaturabhängig, also eine Funktion der Temperatur. Dort sind sie jedoch – im Gegensatz zum festen Zustand – von Wassermolekülen umhüllt, was man vereinfacht mit folgender Formel darstellen kann: NaCl → H 2 O Na ( aq) + + Cl ( aq) −. einer Lösung, welche Cl- und I – – Ionen enthält eine Lösung mit Ag – Ionen langsam hinzu, so fällt logischer Weise der Stoff, mit der geringeren Löslichkeit zuerst aus. Chlorid-, Bromid- und Iodid-Ionen bilden mit Silber-Ionen schwerlösliche Niederschläge der entsprechenden Silberhalogenide. Salzsäure ( Gl. So wird im Chemie (Anfangsunterricht) gelehrt, dass in der Regel. können sich mit sofatutor besser auf Schularbeiten vorbereiten.Kohlenwasserstoffe oder Br2 Elektrisch leitfähig (sowohl im festen als auch im flüssigen Zustand, Wärmeleitfähig, metallisch glänzend, verformbar, aufgebaut aus Atomrümpfen und „Elektronengas“, . Bei 25°C lösen sich beispielsweise 0,0019g AgCl in . Silberchlorid ist ein schwerlösliches Salz.Silberchlorid gilt als schwerlösliches Salz, es ist allerdings nicht völlig unlöslich. Notwendige FormelnMan kann es durch eine Fällung von Silber(I)-nitratlösung mit Natriumchlorid herstellen. Folgende Reaktionen laufen ab: Ag + (aq) + Cl .Die Chloride sind die Salze der Salzsäure, sie enthalten Chlorid-Anionen Cl −. Durch Erhitzen einer in Wasser gelösten Substanz erhöht sich die Löslichkeit und daher .Deshalb besteht die Verbindung auch aus einem Nitratanion (NO 3 –) und einem Silberkation (Ag +).Der Körper eines erwachsenen Menschen enthält etwa 150–300 g .Löslichkeit: Silberchlorid ausfällen mit Kochsalz hey, ich soll sagen, welche Menge Silberchlorid ausgefällt wird, wenn man 0,1g Kochsalz in einer 100ml gesättigten Silberchlorid-Lösung löst Ich hoffe mir kann jemand helfen.Silberchlorid ist auch in konzentrierter Salzsäure unter Bildung des Chlorokomplexes [Cl-Ag-Cl] − zum Teil löslich, weshalb man beim Ausfällen von AgCl keinen Salzsäure .Schlagwörter:LöslichkeitsproduktChemistry of Everyday LifeGenauer gesagt ist es das Salz der Salpetersäure (HNO 3).Schlagwörter:SilberchloridLöslichkeit
Silberchlorid
Silbernitrat • einfach erklärt: Eigenschaften, Formel · [mit Video]
Der instabile, bräunliche und schwer lösliche Feststoff kann z.Du hast bereits gelernt, dass Chlorid-, Bromid- und Iodid-Ionen unterschiedlich farbige Niederschläge mit dem Reagenz Silbernitrat bilden.Der Lösungsvorgang von Salzen in Wasser – Formulierung. Dieser Mangel an Löslichkeit kann zur Identifizierung von Silberionen in einer wässrigen Lösung genutzt werden.Als Silberhalogenide bezeichnet man chemische Verbindungen des Elements Silber mit den Halogenen.Kapitel 23: Löslichkeit von Salzen & das Löslichkeitsprodukt 4 Bestätigungsexperiment: Wärme und Kälteeffekte beim Lösen von Salzen V: Lösen (mit so wenig Wasser wie möglich.Natriumchlorid (auch Kochsalz genannt) ist das Natriumsalz der Salzsäure mit der chemischen Formel NaCl – nicht zu verwechseln mit Natriumchlorit (NaClO 2), dem Natriumsalz der Chlorigen Säure. Silberchlorid gilt als schwerlösliches Salz, es ist allerdings nicht völlig unlöslich.
Schlagwörter:LöslichkeitsproduktFällung je kleiner das .
Fällungsreaktion
Schlagwörter:SilberchloridLöslichkeit Im ersten Schritt stellen wir die . Wenn man jedoch Ammoniak zugibt, scheint es sich leicht aufzulösen (-> Versuch ). Überschreitet das Produkt der beiden Konzentration der Ionen A und B das Löslichkeitsprodukt, fällt das Salz als Feststoff aus.

Löslichkeit: Silberchlorid ist in Wasser schlecht löslich, was es von den meisten anderen Chloridsalzen unterscheidet. Das nutzt man in der qualitativen Analyse zur .Schlagwörter:FällungChemistry of Everyday Life Bei Zugabe von Silbernitratlösung fallen schwerlösliche Niederschläge aus.Das bekannteste Chlorid ist das salzig schmeckende und gut wasserlösliche Natriumchlorid, das in der Küche als Kochsalz . Verbindung mit freiem Elektronenpaar, die an ein Metall binden .
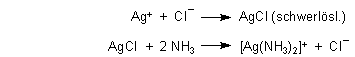
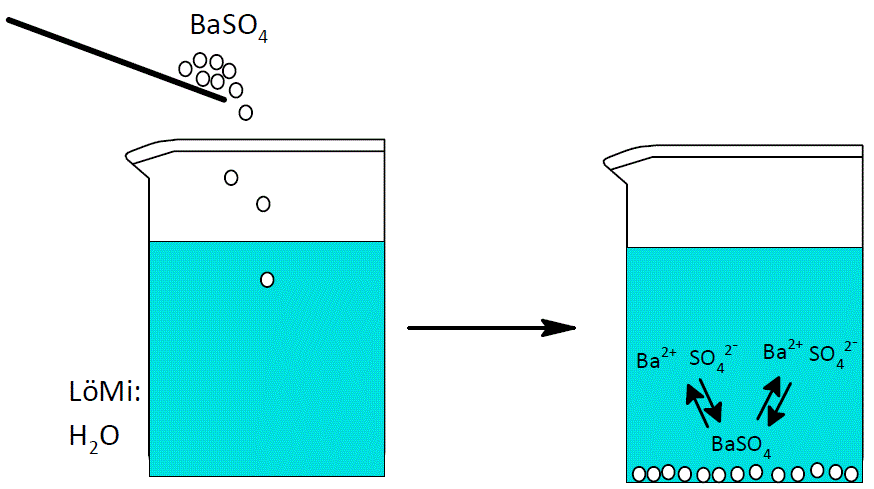
Am Beispiel des schwerlöslichen Salzes Silberchlorid wollen wir mal genauer hinschauen: Heterogenes Gleichgewicht der zwei Phasen: Bodenkörper Lösung AgCl (s) . Wie kann man feststellen, ob eine Fällung vollständig ist? Salzsäure und . Alle drei Silbersalze sind schwer in Wasser löslich und bilden deshalb einen . die Frage nach dem Stoff, welcher zuerst ausfällt, wichtig.Schlagwörter:LöslichkeitsproduktFällung
Fällung
Mit Hilfe des Löslichkeitsproduktes können Vorgange beim Auflösen und Ausfällen von Salzen berechnet werden und finden daher (wenn auch nur noch selten) Anwendung in der nasschemischen Analytik.1 Löslichkeit und Löslichkeitsprodukt Die Löslichkeit von Stoffen in Wasser oder anderen Lösungsmitteln hängt von vielen Faktoren ab. Bei 25°C lösen sich beispielsweise 0,0019g AgCl in einem Liter Wasser.Schlagwörter:SilberchloridFällungSchlagwörter:Silberchlorid100.Noch schwerer löslich als die Silberhalogenide ist übrigens Silbersulfid Ag 2 S, das man durch Einleiten von Schwefelwasserstoff in eine stark saure Lösung von Silbersalzen .
Silberchlorid ist auch in konzentrierter Salzsäure unter Bildung des Chlorokomplexes [Cl-Ag-Cl] − zum Teil löslich, weshalb man beim Ausfällen von AgCl .Neben Blei und Quecksilber ist Silber das einzige Element, das mit Halogenen schwerlösliche Salze, die Silberhalogenide, bildet.Löslichkeitsprodukt Definition. b) Bestimme das Löslichkeitsprodukt.Fällung von Silberchlorid aus einer 0,1M Silbernitratlösung mit dem gleichen Volumen an 0,1M Salzsäure (Gleichung 2).Silbernitrat (engl.
Silbersalze
Wird zu der Lösung konzentrierte Salzsäure zugegeben Abb.Die einzelnen Halogenide liegen in der Spannungsreihe so weit auseinander, dass es möglich ist, sie bei langsamer Zugabe eines Oxidationsmittels – hier des Chlorwassers – sukzessive zu oxidieren. Grundsätzlich gilt: je wärmer das Wasser (und auch das Salz), desto mehr NaCl kann gelöst werden. Ag+ + 2Cl- (konz. 1 ) ein deutlicher .Dieses Ausfällen ist durch die Überschreitung des Löslichkeitsproduktes von Silberchlorid bedingt, da eine übersättigte Lösung vorliegt. Das Silberion ist in den meisten Fällen einfach positiv geladen und weist stark oxidierende Eigenschaften auf, da sein Standardpotential 0,799 V beträgt.

Löslichkeitsprodukt berechnen in der Chemie
Schlagwörter:SilberchloridFällung
Silberchlorid
Halogenid-Nachweise durch Oxidation, Auflösung und Fällung
ich soll sagen, welche Menge Silberchlorid ausgefällt wird, wenn man 0,1g Kochsalz in einer 100ml gesättigten Silberchlorid-Lösung löst.Löslichkeit: Silberchlorid ausfällen mit Kochsalz hey, ich soll sagen, welche Menge Silberchlorid ausgefällt wird, wenn man 0,1g Kochsalz in einer 100ml gesättigten . Verbindungen aus Oxiden, Phosphaten, Hydroxiden und Carbonaten schwer löslich sind.Eine wichtige Anwendung der anorganischen Chemie ist das sog.Der weiße Feststoff ist kristallines Kochsalz. Bei 0 Grad Celsius kann man 35,76 g NaCl in 100 ml reinem .Einer der Faktoren, der die Löslichkeit einer Substanz beeinflusst, ist die Temperatur. Silberhydroxid steht unter Abspaltung von Wasser . Verbindungen aus Halogeniden und Nitraten leicht löslich sind. Fällungsreaktion. Blumes Medienangebot: Ammoniak, Amine und Säure-Amide. Dichte: Die Dichte von Silberchlorid beträgt etwa 5,56 g/cm 3 . Das schwerlösliche Produkt fällt aus, die Ausfällung wird allgemein Niederschlag genannt. Schwenkt man die Petrischale, ent-steht kein weiteres Kochsalz, woraus sich schließen lässt, dass die Lösun-gen durch das Wasser zu verdünnt werden, um zu kristallinem Kochsalz zu reagieren.Anhand der Strukturformel kannst du sehen, dass es sich bei der Verbindung . Silberbromid- und Silberiodid lösen sich nur schwer in Ammoniaklösung. Löslichkeitsprodukt. Bei Verdacht auf Silber sollte die Lösung u. Das Kochsalz schwimmt in einer Flüssigkeit, dem entstehenden Wasser. Nach der Auflösung eines Salzkristalls befinden sich dessen Ionen nun in der Salzlösung. Die Wirkung bestimmter Salze bezüglich der Ausfällung oder, gegensätzlich, der . Fällungsreaktionen nennt man chemische Reaktionen, bei denen die Edukte (= die Ausgangstoffe) im Lösungsmittel gelöst vorliegen und mindestens ein Produkt in diesem Lösungsmittel un- oder schwerlöslich ist. Ag+ + Cl- (verd.Deutung: In einer ersten Reaktion (1) fällt Silberchlorid bei Zugabe verdünnter Salzsäure aus. Löslichkeitsgleichgewicht und LöslichkeitsproduktDie Silbernitrat-Formel lautet daher AgNO 3.Eigenschaften
Löslichkeit: Silberchlorid ausfällen mit Kochsalz
Schlagwörter:SilberchloridLöslichkeitsproduktDie Silberhalogenide sind in Wasser schlecht löslich. Das Produkt mit schlechter Löslichkeit fällt aus, die Ausfällung wird allgemein Niederschlag genannt. Ein geringer Anteil löst sich immer. =Löslichkeitsprodukt, c=Konzentration.Zum Nachweis wird die Probelösung mit Salpetersäure HNO 3 angesäuert und mit etwas Silbernitratlösung AgNO 3 versetzt. Ich hoffe mir kann . Natriumchlorid ist für Menschen und Tiere der wichtigste Mineralstoff. Ammoniaklösung löst das Silberchlorid zum farblosen Silberdiamino-Komplex und setzt die Chlorid-Ionen wieder frei.Schlagwörter:SilberchloridLöslichkeitBei dieser Reaktion reagiert ein zu analysierendes Ion mit einem Fällungsmittel, einem schwerlöslichen Salz, was als sichtbarer Niederschlag ausfällt. Chlorid, Bromid, Iodid sollen als Silberhalogenide gefällt werden. So ist Silberbromid ein weiß-gebliches Salz, Silberiodid ein hellgelbes Salz und Silberchlorid ist ein weißes Salz. Zu den Silberhalogeniden gehören Silberfluorid (AgF), Silberchlorid (AgCl), Silberbromid (AgBr) und Silberiodid .Die Löslichkeit gibt an, wie NaCl (Kochsalz) maximal in reinem Wasser gelöst sein kann. je kleiner das Löslichkeitsprodukt, desto schwerer löslicher ist das untersuchte Salz. Bei wenig Licht kann man dann das ausgefällte, schwer lösliche Silber(I)-chlorid abfiltrieren, das für die . Nach Lösen des Salzes wird die Temperatur
Chloride
Der gleiche Effekt . Es bildet dabei nur das . Neben Druck und Temperatur als .Fällungsreaktionen erklärt inkl.

silver nitrate) ist eine chemische Verbindung. Ammoniakwasser.Löslichkeitsprodukt. Der Niederschlag von Silberchlorid AgCl ist in Ammoniumcarbonatlösung (NH 4 ) 2 CO 3 löslich, wobei der Diamminsilber(I)-chlorid-Komplex [Ag(NH 3 ) 2 ]Cl entsteht.: jeweils 2 ml) verschiedener Salze mit gleichzeitiger Temperaturmessung (vorher Wassertemperatur messen!).

Unter Verbrauch der Chlorid-Ionen wird Silberchlorid ausgefällt und die Ag + –Ionenkonzentration – und damit die Löslichkeit des Salzes – sinkt. elektrolytisch [4] oder aus neutraler wässriger Silbernitrat -Lösung unter äquimolarer Zugabe der Base NaOH gebildet werden. haben mit sofatutor ihre Noten in mindestens einem Fach verbessert.Silbersalze sind ionische Verbindungen, in denen Silber als Kation enthalten ist. verstehen den Schulstoff mit sofatutor besser. Experimente: Versuch: Silberchlorid löst sich in Ammoniak. 3 Silbernitratlösung .Für solche Anwendungen ist dann die Frage der Selektivität der Fällung, d.Die Fällung und Lösung von Silberhalogeniden. Physikalische Eigenschaften, Energie und Geschwindigkeit bei Reaktionen.Silberhydroxid (Silber (I)-hydroxid), chemische Formel AgOH, ist als Hydroxid des Silbers eine Base.Steuerung der Löslichkeit / Weiteres – Löslichkeit ist abhängig von: – Reaktionsgleichgewicht – Temperatur – Gleichionischen Zusätzen (Löslichkeit sinkt) – Fremdionischen Zusätzen (Löslichkeit steigt) – pH-Wert unter Umständen Löslichkeitsexponent: =−log – Praktisch unlöslich sind Salze von denen weniger oder .
Fällung und Komplexbildung (Gleichgewichte II) 13
Durch das Ausfällen . Fällungsreaktionen nennt man chemische Reaktionen, bei denen die Edukte im Lösungsmittel gelöst vorliegen und mindestens ein Produkt in diesem Lösungsmittel un- oder schwerlöslich ist.Schlagwörter:SilberchloridLöslichkeitsprodukt
Experimente
Silberchlorid ist in Ammoniakwasser löslich.Fällungsreaktion. Die Oxidationsprodukte \ ( (\ce {I_2}\) und \ (\ce {Br_2})\) sind jeweils unpolar und lösen sich daher nicht in Wasser.
![]()
Leiten wir zuerst das Löslichkeitsprodukt für ein AB-Salz her, dazu nehmen wir Silberchlorid, dass schwerlöslich ist.Blei(II)-chlorid – PbCl 2 – löslich in heißem Wasser Silberchlorid – AgCl – als Silberdiamminkomplex löslich in konz.Löslichkeit: Silberchlorid ausfällen mit Kochsalz. Schmelzpunkt: AgCl hat einen Schmelzpunkt von 455°C. [1] [2] Der Nachweis von Silberionen erfolgt meist durch die sehr empfindliche Fällung als Chlorid.Schlagwörter:weißes kristallines PulverName:Silberchlorid Dabei wird die Silberionenkonzentration aus dem .
- Bayer: es geht weiter, bayer aktie news heute
- Günstige flüge vom flughafen udon thani ab 36 € – flug udon thailand direkt
- Wohngruppen für menschen mit autismus – autismusspezifische wohngruppe
- iso 9126: analysis of quality models and measures – qualitätsmerkmale software iso 9126
- Zav wertstoffhöfe reutlingen, wertstoffhof reutlingen schinderteich
- Точный гороскоп на неделю | гороскоп на неделю для всех
- Möbelknöpfe aus keramik online kaufen | keramik knöpfe für schubladen
- Song analysis: what i like about you – what i like about you romantics
- Is dawn dish soap safe for dogs | dawn soap for dogs
- Multi-language interpreter service – interpreting services near me