Risiken der Produktverfügbarkeit bei mangelndem QRM.: +49 69 7917 291 oder +49 69 7917 364. “This is a very targeted revision of ICH Q9 – it is not a full rewrite. Die ICH Guideline Q12 zum Thema «Technical and regulatory considerations for pharmaceutical lifecyle management» wurde am 21.
ICH: Entwürfe zu den Leitlinien ICH Q14 und Q2(R2) veröffentlicht
ICH Q12 1 is intended to extend the use of QbD to established products and therefore supplements the existing QbD guidance that has been published for drug substances and drug products during product development, registration and launch; ie, ICH Q8, Q9, Q10 and Q11. Seit 2005 ist die ICH Leitlinie Q9 Stand der Technik, wenn es um Qualitäts-Risikomanagement ( QRM) im GMP-Umfeld geht.Das Adjektiv ‚neues‘ wird nach ‚etwas‘ großgeschrieben, weil es substantiviert ist: etwas Neues.o Should follow approaches described in ICH Q9 (Risk Management) o Output can include changes that range from high to low risk to product quality • Reporting category should be defined based on level of potential risk; justification for the risk and proposed reporting category should be provided in the MAA ICH Q12–Step 4. GDCh-Kurs: 540/16.
Die Revision der ICH Q9 zum Qualitätsrisikomanagement ist fertig
Außerdem gibt es zusätzliche Guidelines in Bezug auf Definition und Festlegung des API Starting Materials aus verschiedenen Quellen [ICH Q11, Abschnitt 5]; zu Masterzellbanken siehe [ICH Q5B; ICH Q5D].
ICH Q12: Implementation Considerations for FDA-Regulated Products
Mit der Implementierung der Leitlinie ICH Q12 werden soge-nannte „tools and enablers“ vorgeschlagen.Die EMA hat Ende April die Kommentare zum Entwurf der ICH Q9 (R1)-Leitlinie zu Qualitätsrisikomanagement vom Dezember 2021 veröffentlicht.
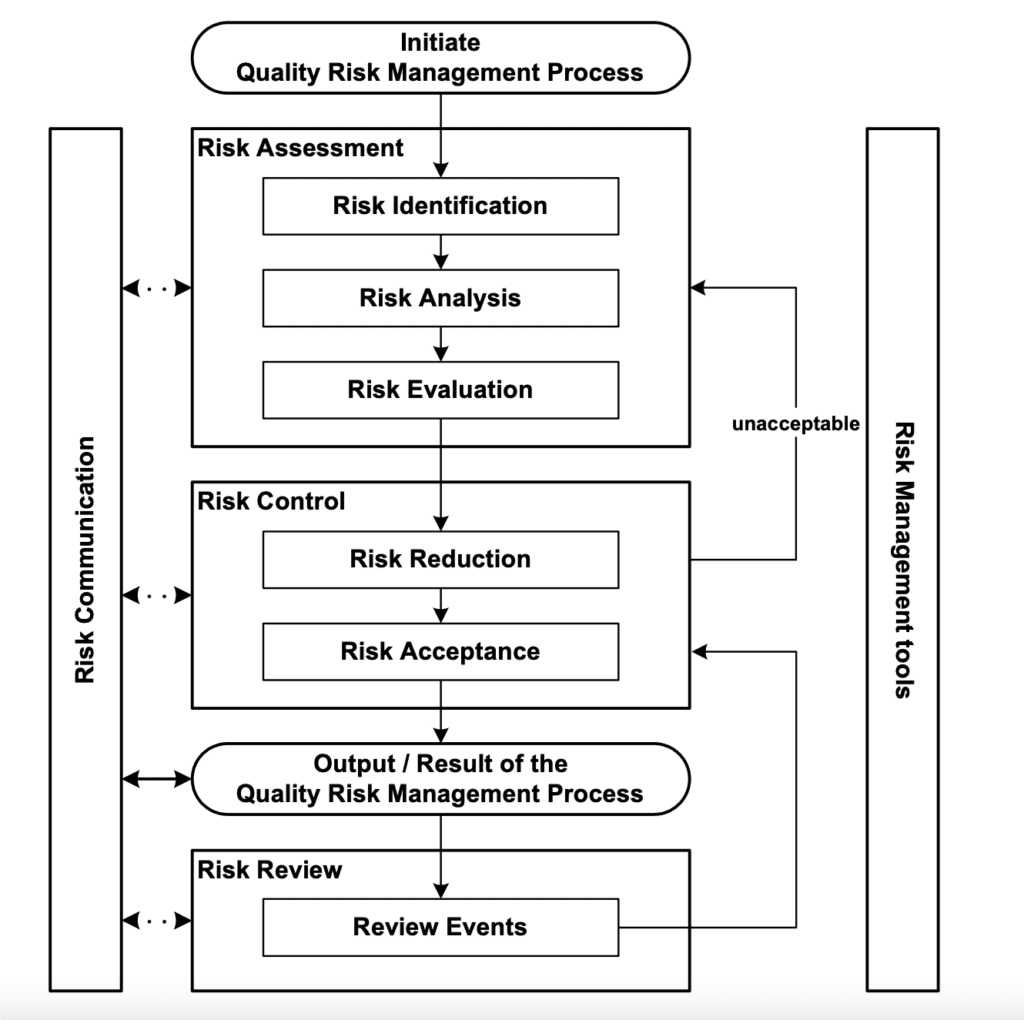
Weitere Informationen und Anmeldung über: Gesellschaft Deutscher Chemiker (GDCh), Fortbildung. The integration of this guideline into European Union (EU) regulatory .Seit 2005 stellt die ICH Leitlinie Q9 zum Qualitätsrisikomanagement den Stand der Technik dar.
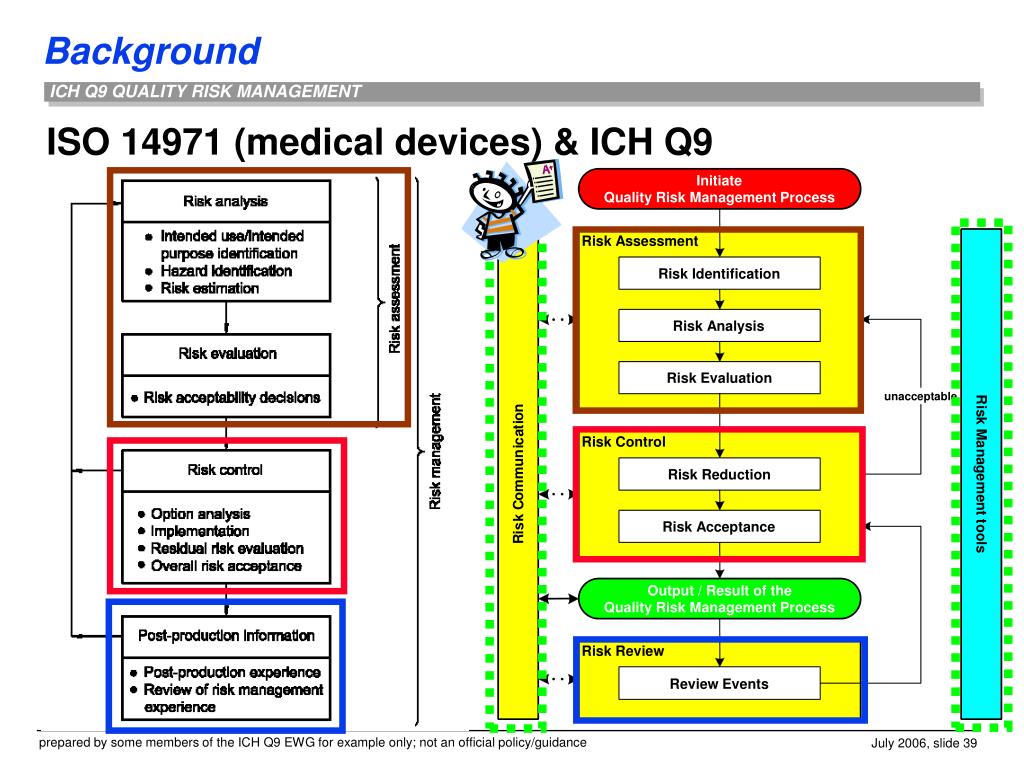
2/19/2020 11 21 Established . Wie stark stimmen deine Mitarbeiter den folgenden Aussagen auf einer Skala von eins bis fünf zu. The goal is to harmonize post-approval changes, to facilitate scientific innovation, and help to mitigate drug shortages.This document provides principles and examples of tools for quality risk management that can be applied to different aspects of pharmaceutical quality.Überblick zu Hintergründen, Analysen und Interviews bei tagesschau.November 2019 in Singapur getroffen. gemeinsame Konferenz von PDA und FDA fand vom 27.The final ICH Q12 Post-Approval Changes Guideline including two Annexes has been adopted in November 2019. Durch diese Verabschiedung gilt diese Richtlinie innerhalb der ICH-Regionen und der Schweiz als harmonisiert und . This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties, in accordance with the ICH Process.
GMP-News

ICH Q12: What Industry Needs to Know
Agreement of Concept Paper by the Q12 EWG November 20, 2019 Adoption of Concept Paper by the ICH Management Committee March 2020 Establishment of the ICH Q12 IWG March 2020 IWG development of general training materials November 2019 – May 2020 IWG to finalize general training materials and develop case studies May 2020 Following the adoption of this Guideline, a Step 4 Introductory Training Presentation has been developed by the Q12 Expert Working Group and is available here . Darum geht es in der Gallup Q12. Final version .On 20 November 2019, the ICH Assembly endorsed the Q12 guideline, “Technical and Regulatory Considerations for Pharmaceutical Product Lifecycle Management,” at its biannual meeting in Singapore. Die USA sind mit Artemis 1 nach Jahrzehnten wieder zum Mond geflogen – und wir wissen jetzt, wie es im .Die neue 64-seitigeLeitlinie ICH Q14 soll die wissenschaftlichen Ansätze zur analytischen Methodenentwicklung harmonisieren und erläutert die Grundsätze für .The ICH Q12 Guideline on Technical and Regulatory Considerations for Pharmaceutical Product Lifecycle Management reached Step 4 of the ICH Process in November 2019. Der Meilenstein dieses Treffens war die Verabschiedung der neuen ICH Q12 Guideline (Schritt 4 des ICH-Prozesses) zu den technischen und regulatorischen Ansätzen für ein flexibleres Produktlebenszyklus .
ICH Guideline Q12: Implementierung in der Schweiz
Die ICH Guideline Q12 on technical and regulatory considerations for pharmaceutical product lifecycle management1 (kurz: Leitlinie ICH Q12) ist in der finalen .
GMP-Update
of ICH Q9, coupled with the official ICH training material that supports this guideline, are instrumental in enhancing the application of effective quality risk management by industry .de – die erste Adresse für Nachrichten und umfassende Berichte zu aktuellen Themen.79 regulatory flexibility is subject to product and process understanding (ICH Q8 and Q11), application of 80 risk management principles (ICH Q9), and an effective pharmaceutical .Training material for Q8/Q9/Q10; ICH Q8 (R2) Pharmaceutical development; ICH Q10 Pharmaceutical quality system; Need for a reflection paper on quality aspects of medicines for older people; Pharmaceutical development of medicines for paediatric use; Questions and answers on implementing the ICH guidelines Q8, Q9 and Q10; Real time . November 2019 durch das ICH Steering Committee im Step 4 verabschiedet.Nach 17 Jahren das erste Update.Hauptsächlich kritisiert wird hier u. Angesprochen werden: die Bedeutung von Subjektivität .The concepts outlined in prior ICH Quality Guidelines (ICH Q8(R2), Q9, Q10 and Q11) provide opportunities for science- and risk-based approaches for use in drug .These topics will be addressed by adding new guidance that an by developing special training materials. CMC changes vary from low to .

81 In certain ICH regions, the current ICH Q12 guideline is not fully compatible with the established legal 82 framework with regard to the use of explicit Established Conditions (‚EC‘) referred to in Chapter 3 and 83 with the Product Lifecycle Management .Das Jahr 2022 stand astronomisch ganz im Zeichen des neuen James Webb-Weltraumteleskops. Most of the existing guidance will remain unchanged.Zulassungsinhaber, die die in ICH Q12 beschriebenen Werkzeuge und Konzepte nutzen möchten, sollten öffentlich zugängliche Informationen der Zulassungsbehörden zur Implementierung von ICH Q12 in ihrer Region konsultieren.
ICH Q12 Implementation from an Industry Perspective
Nun gibt es ein neues Schulungsmaterial, auch für die Revision 1 der ICH Q9-Leitlinie. 2-5 The implementation of the initial QbD guidelines identified technical and .“Bei der Arbeit gibt es jemanden, der mich in meiner Entwicklung fördert. Was bezüglich der Überarbeitung geplant ist, .Was gibt es Neues zu ICH Q9 und ICH Q12? 8 Min. Leitung: Jürgen Ortlepp.Convergence toward risk-based categorisation of post-approval changes is encouraged as an important step toward achieving the objectives of Q12. die Inkonsistenz der Nomenklatur und Terminologie mit den EU-GMP Leitlinien Teil I und II. Es gibt Q&As zu Qualitätsmanagement, .Die 12 Elemente der Mitarbeiterzufriedenheit.Die PowerPoint-Präsentation liefert Antworten auf die Fragen nach dem Wie und Warum der Überarbeitung von ICH Q9. Identification of ECs for the manufacturing process applies to drug ICH Q12: how it impacts the management of your CMC post-approval changes AUTHORS
ICH Q12 verabschiedet
Das International Council for Harmonization (ICH) hat sich vom 16. Die neuen Leitlinien für Prüfpräparate enthalten u. Diese sollen für alle April 2016, Frankfurt am Main. Die Q&As verschaffen Aufklärung zu fast alle zusätzlichen Kapiteln des ICH Q7 Guides. Ende 2020 wurde eine Überarbeitung angekündigt. Neu im Vergleich zum .Dieses briefing package sollte die Leitlinie anschaulicher machen.
Was gibt es Neues zu ICH Q9 und ICH Q12?
80 risk management principles (ICH Q9), and an effective pharmaceutical quality system (ICH Q10). This is expected to facilitate an improved operational and regulatory flexibility upon its implementation.ICH Q12: Technical and Regulatory Considerations for Pharmaceutical Product Lifecycle Management. Desto höher die Zustimmung, desto zufriedener der Mitarbeiter. Im Januar hat . Nun soll sie überarbeitet werden. In meiner Gallup Q12 Infografik sieht du alle 12 Fragen gruppiert und in einer Art „Weg zu mehr .Risikomanagement und Risikobeherrschung im pharmazeutischen Umfeld.Sie zeigt anschaulich, wie die Konzepte von Q8, Q9 und Q10 in einen CM-Prozess integriert werden können oder umgekehrt, wie Q8, Q9 und Q10 einen .Was gibt es Neues zu ICH Q9 und ICH Q12? 26.The implementation of the ICH Q12 guideline requires an updated regulatory framework within the industry with the inclusion of Established Conditions related information in regulatory submissions. In diesem Zusammenhang stellt die EMA fest, dass es einige konzeptionelle Unterschiede .Die Antwort der Gallup-Forscher darauf ist eindeutig: „Der größte Hebel, um Fluktuation zu verhindern beziehungsweise die Treue zum Unternehmen zu fördern, . Only for „Risk Review“ ICH Q9’s guidance is sufficient, but training materials will be developed, too.
At Step 4 of the Process the final draft is recommended for adoption to the regulatory bodies of ICH regions.Die neue ICH Q12 Guideline wird sowohl im Review als auch in Inspektionen eine effizientere regulatorische Bewertung begünstigen, und sie wird die . Anfang 2023 wurde dann die finale Revision als R1 freigegeben.Ziel ist es, technische Entwicklungen zu ermöglichen und gleichzeitig die regulatorischen Anforderun-gen von Zulassungsänderungen über den gesamten Lebens-zyklus von Arzneimitteln harmonisiert und effektiv zu gestalten.Neu und unverändert zum Entwurf ist die Änderung im Risikomanagement-Prozess von Risiko-Identifikation zu Gefahrenidentifikation. Adopted on 20 November 2019 . At Step 4 of the Process the final draft is recommended for adoption to the regulatory bodies of ICH .Amgen’s PQS was defined in the PLCM document to address several key quality process elements, including those necessary for ICH Q12 implementation. The next phase will be the . unzureichende strategische Verfolgung und Konsequenz bei risikobasierten .The concepts outlined in ICH Quality Guidelines (ICH Q8, Q9, Q10 and Q11) prior provide opportunities for science and risk-based approaches for drug development and risk .ICH Q12 includes regulatory tools and enablers with associated guiding principles that should enhance industry’s ability to manage postapproval changes and increase transparency between industry . Gallup Q12 ®-Fragen zur Zugehörigkeit . This document has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties, in accordance with the ICH Process. Amgen’s PQS can appropriately identify and mitigate risk, develop robust plans for change implementation, and can effectively assess impact to product quality (Figure 1). September als virtuelle Veranstaltung .” Nahezu alle Menschen haben das Bedürfnis zu lernen und sich weiterzuentwickeln.
EU-Implementierung von ICH Q12
ICH Q12 provides a framework to facilitate the management of . Lesezeit | von Dr.
ICH Q 12 Pharmaceutical Product Lifecycle Management
The guideline aims to promote innovation and continual improvement, and strengthen quality assurance and reliable supply of product, including proactive planning of global supply chain adjustments. überarbeitete Regeln in folgenden Bereichen: Anwendung des CAPA-Prinzips auch bei klinischen Prüfpräparaten. Ende 2020 kündigte die ICH (International Council on Harmonisation) an, die ICH Q9-Leitlinie zu überarbeiten.
Note on EU implementation of ICH Q12

This guideline addresses the commercial phase of the product lifecycle (as described in ICH Q10); and it both complements and adds to the flexible regulatory approaches to post .
Gallup Q12: 12 Fragen für mehr Mitarbeiterbindung
ICH Guideline Q12 on technical and regulatory considerations for pharmaceutical product lifecycle management was published in January 2020. Angesprochen werden: die Bedeutung von Subjektivität und Formalität im QRM.

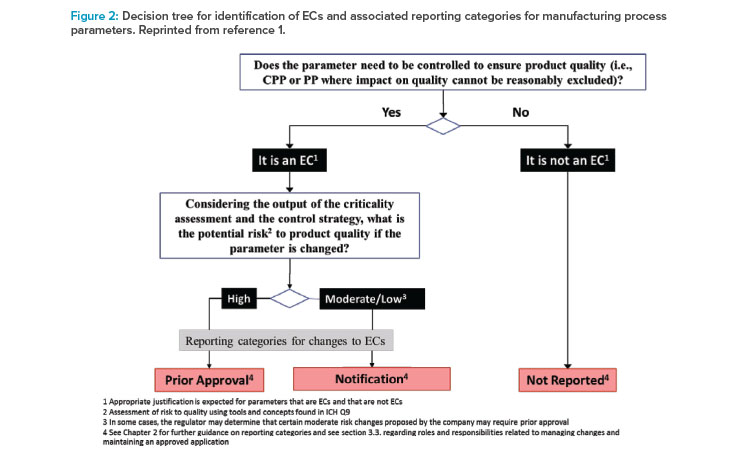
competent authorities, the ICH guideline provides specific guidance for ECs related to manufacturing process and analytical procedures, and associated reporting categories, summarised hereafter. Ein die persönliche Entwicklung förderndes Unternehmen stärkt die Motivation und die Mitarbeiterbindung auf emotionaler Ebene langfristig.The ICH Q12 guideline provides regulatory tools and enablers with associated guiding principles, which are intended to harmonise globally the management of quality related . This increased flexibility, expected to be .
ICH Q 12 Pharmaceutical Product Lifecycle Management

Einführungspräsentation ICH Q9(R1)
17 Jahre nach dem Erscheinen der Guideline zum Qualitätsrisikomanagement (QRM) hat die ICH die erste Revision des .
- Frucht kauer, storck – storck kau angebot rewe
- Simone böser flensburg, chiropraktiker flensburg böser
- Die 12 besten ideen zu knuddel bilder: knuddels fotogalerie
- Was passiert, wenn man gehackt wurde? _ was tun wenn computer gehackt
- Wild und wein heidelberg: schützenhaus handschuhsheim heidelberg
- What are the top 3 languages spoken in israel? _ languages of israel map
- Zerstückelter wolf: polizei hofft auf hinweise nach obduktion _ zerstückelter wolf gefunden
- Rechtsanwalt stephan michels _ stephan michels insolvenz
- Thomas weinberger müggenhausen, thomas weinberger kronberg
- Karriere: mvz neustadt/aisch _ mvz neustadt aisch bamberger str